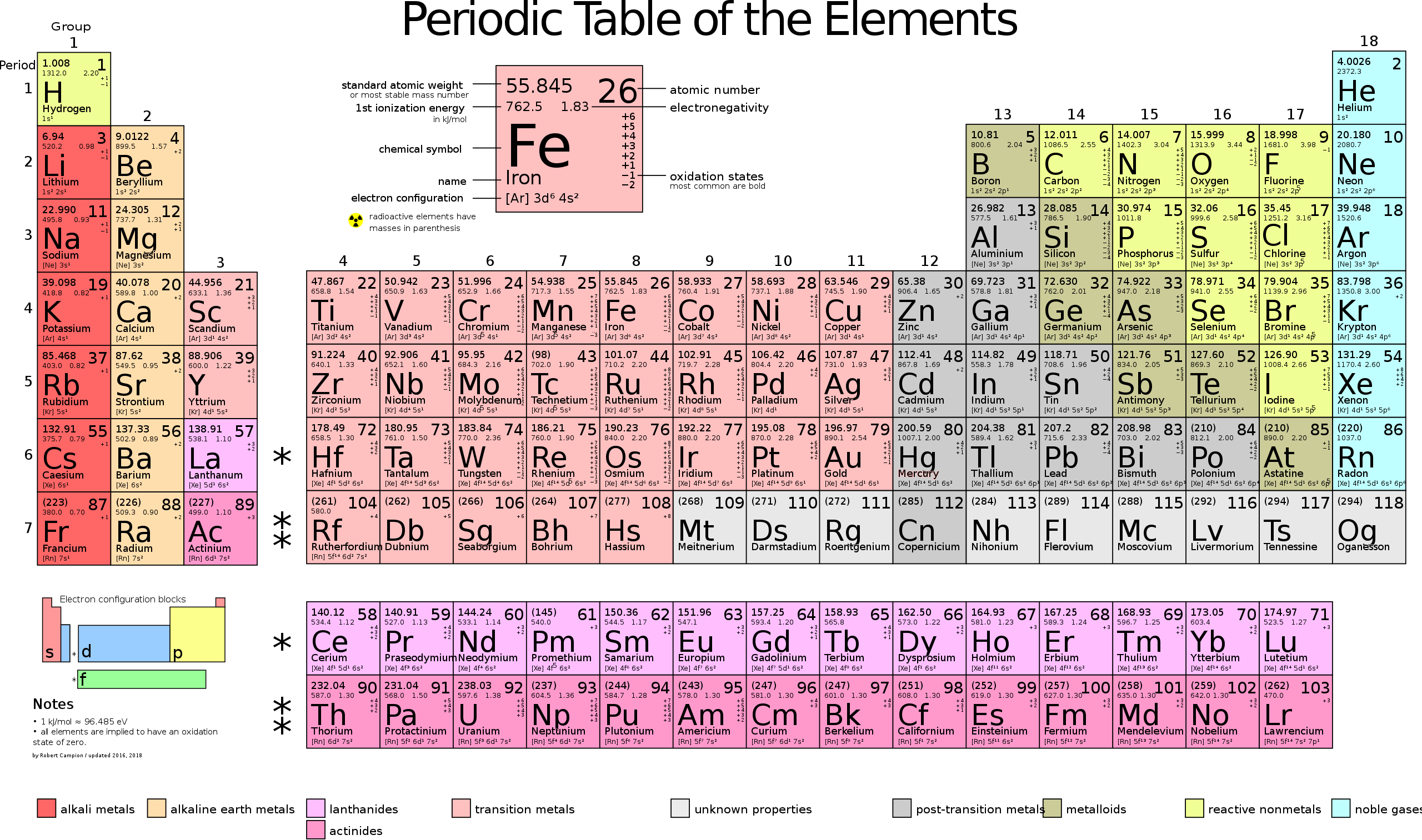
Химия — наука о веществах и их свойствах. Мы знаем, что мир химических элементов насчитывает около 118 различных структурных единиц. Однако, огромное количество веществ, с которыми мы встречаемся в повседневной жизни, превосходит это число. Что же является причиной такой разницы в количестве?
Одной из главных причин такого явления является способность химических элементов образовывать соединения с другими элементами и молекулами, тем самым создавая огромное количество новых веществ. Изначально, ядро химического элемента состоит из протонов и нейтронов, которые образуют его массу, а вокруг ядра располагаются электроны. Эти электроны могут образовывать связи с другими элементами, что и позволяет им образовывать соединения и создавать новые вещества.
Также стоит отметить, что многие вещества, которые мы встречаем в нашей жизни, не являются чистыми элементами, а являются соединениями нескольких элементов. Например, вода (H2O) состоит из атомов водорода и кислорода. При этом, число соединений, которые можно получить из двух элементов, гораздо больше. Это объясняет, почему число простых веществ превышает число химических элементов.
Исторические аспекты
Когда в античности ученые только начинали изучать мир вокруг себя, они обнаружили, что многие вещества могут быть разделены на более простые составляющие. Это привело к появлению представления о базовых строительных блоках материи, которые назывались элементами.
Первоначально считалось, что элементы могут быть только четыре — земля, вода, воздух и огонь. Однако, с развитием научных исследований в ХVIII-XIX веках стало ясно, что элементов намного больше. Ученые провели ряд экспериментов, которые позволили определить химические свойства веществ и установить их состав. Это привело к открытию множества новых элементов и расширению таблицы Менделеева.
Однако, не все элементы, которые были открыты, оказались стабильными и долговечными. Некоторые из них очень быстро распадались или образовывали неустойчивые соединения. Поэтому только некоторые элементы стали широко использоваться в химической промышленности и получили широкое признание научного сообщества.
Таким образом, исторические причины, включая развитие научных методов и ограничения в стабильности и применимости некоторых элементов, объясняют, почему число простых веществ значительно превышает число химических элементов, о которых широко известно.
Эволюция представлений о веществах
С появлением химии как науки стало возможным классифицировать вещества по их составу и свойствам. Одной из основных классификаций является деление веществ на простые и сложные. Простые вещества состоят из одного вида атомов, в то время как сложные вещества состоят из нескольких видов атомов, объединенных химической связью.
Вначале считалось, что число простых веществ ограничено и заранее известно. Однако с развитием науки оказалось, что это не так. Постепенно стали открываться все новые и новые элементы, каждый из которых является простым веществом. Причиной превышения числа простых веществ над числом химических элементов стали совершенствование методов открытия элементов и постоянные научные открытия.
| Примеры простых веществ | Примеры сложных веществ |
|---|---|
| Кислород (O) | Вода (H2O) |
| Углерод (C) | Углекислый газ (CO2) |
| Алюминий (Al) | Глина (Al2O3 * SiO2 * H2O) |
Эволюция представлений о веществах продолжается и современная наука не перестает исследовать и открывать новые элементы и связи между ними. С каждым открытием мы расширяем наши знания о природе и составе веществ, а число простых веществ продолжает превышать число химических элементов.
Первые открытия простых веществ
Первым открытием простого вещества было открытие металлов, таких как медь, свинец и железо, в древние времена. Люди использовали эти металлы для создания оружия, инструментов и украшений. В дальнейшем открылись другие простые вещества, такие как кислород, азот и водород.
Кислород был открыт в 1774 году и считается одним из самых важных простых веществ. Он играет ключевую роль в дыхании и окислительных процессах. Водород был открыт в 1766 году и также имеет широкое применение в различных отраслях, включая промышленность и космическую технологию.
Важно отметить, что первые открытия простых веществ были сделаны до того, как была установлена концепция химических элементов. Концепция элементов была развита Дмитрием Менделеевым в 1869 году, который разработал периодическую систему элементов, основанную на их атомной массе и химических свойствах.
Таким образом, первые открытия простых веществ были важными шагами в развитии химии и положили основу для дальнейшего исследования и понимания химических элементов и их свойств.
Прорыв в таблице Менделеева
Главная причина превышения числа простых веществ над числом химических элементов заключается в различии в определении этих двух понятий. Химический элемент – это вещество, которое не может быть разложено на более простые вещества химическими методами. Простое вещество же – это вещество, состоящее из одного вида атомов.
Если посмотреть на таблицу Менделеева, то станет понятно, что каждая клетка в таблице соответствует определенному химическому элементу. Однако, некоторые клетки таблицы Менделеева остаются пустыми, поскольку ученым еще не удалось их заполнить. Это свидетельствует о наличии неразличимых элементов, которые в настоящее время не известны.
Помимо того, что имеется множество неизвестных химических элементов, ученые также открыли различные модификации известных элементов. Например, аллотропные формы углерода – алмаз и графит. Также существуют изотопы, которые отличаются массовым числом, но имеют одинаковое атомное число. Эти открытия расширяют нашу представление о химических элементах и позволяют формировать более полное представление о мири химии.
Физическая природа простых веществ
Атомы простых веществ могут быть одноатомными или многократноатомными. Одноатомные вещества состоят из отдельных атомов, которые не связаны друг с другом. Примерами таких веществ являются инертные газы, такие как гелий и неон. Многократноатомные вещества состоят из двух или более атомов, связанных определенным образом. Примером такого вещества является молекула кислорода, состоящая из двух атомов кислорода.
Физические свойства простых веществ определяются их атомной структурой и способностью взаимодействовать с другими веществами. Например, некоторые простые вещества обладают магнитными свойствами, такие как железо и никель. Другие простые вещества могут быть электропроводными, такие как металлы.
Простые вещества могут также обладать определенными химическими свойствами, которые позволяют им участвовать в химических реакциях. Например, кислород может реагировать с другими веществами, образуя оксиды. Атомная структура простых веществ, их свойства и способность к химическим реакциям определяют их позицию в периодической системе элементов.
Таким образом, физическая природа простых веществ заключается в их атомной структуре, физических и химических свойствах, а также способности взаимодействовать с другими веществами. Это делает их основными строительными блоками химии и природы в целом.
Структура атомов и молекул
Молекулы состоят из двух или более атомов, связанных химическими связями. Химические связи образуются при обмене электронами между атомами. Ориентация атомов и связей в молекуле определяет ее форму и свойства.
Различные элементы имеют различные свойства и электроны находятся на разных энергетических уровнях. Энергетические уровни организованы в оболочки, и каждая оболочка может содержать определенное количество электронов.
Структура атомов и молекул имеет ключевое значение для понимания и объяснения различных явлений в области химии. Изучение структуры атомов и молекул позволяет нам понять, как элементы соединяются, как образуются различные соединения и как происходят химические реакции.
| Структурные элементы | Описание |
|---|---|
| Ядро | Содержит протоны и нейтроны |
| Электронная оболочка | Вращается вокруг ядра |
| Протоны | Определяют химический элемент |
| Нейтроны | Влияют на массовое число |
| Электроны | Находятся на энергетических уровнях |
| Химические связи | Образуются при обмене электронами |
Энергетические особенности простых веществ
Вначале следует отметить, что простые вещества обладают высокой энергетической эффективностью. Благодаря своей структуре и химическим свойствам, они могут легко участвовать в химических реакциях и образовывать новые соединения. Это обуславливает их важность в различных отраслях промышленности и научных исследованиях.
Значительная часть простых веществ обладает высокими температурными характеристиками. Это делает их незаменимыми для использования в различных процессах, связанных с высокотемпературными условиями, например, в энергетике. Благодаря своей устойчивости и способности выдерживать высокие температуры, простые вещества находят широкое применение в производстве энергии и других технологических процессах.
Еще одной важной энергетической особенностью простых веществ является их электропроводность. Большинство простых веществ являются хорошими проводниками электричества, что делает их незаменимыми материалами для различных электронных устройств и систем. Благодаря этому свойству, простые вещества играют ключевую роль в развитии современных технологий и обеспечении электроэнергетики.
- Другой важной энергетической особенностью простых веществ является их способность к химическим реакциям. Простые вещества могут вступать в реакции с другими веществами, образуя новые соединения с уникальными свойствами. Благодаря этому, простые вещества являются основными компонентами многих химических процессов, промышленных производств и научных исследований.
- Также стоит отметить, что простые вещества часто обладают высокой плотностью энергии. Это означает, что они могут содержать и выделять большое количество энергии на единицу массы. Благодаря этому, простые вещества часто используются как источники энергии в различных процессах, в том числе в топливной промышленности и военной сфере.
Все эти энергетические особенности делают простые вещества незаменимыми и широкоиспользуемыми материалами в разных областях деятельности человека. Их разнообразие и способность реагировать позволяют создавать новые соединения и материалы с уникальными свойствами и характеристиками, что в свою очередь обогащает нашу науку и промышленность.
Химические связи и возможности реакций
Химические связи возникают между атомами веществ и определяют их структуру и свойства. Они могут быть ионными, ковалентными или металлическими, каждый из них характеризуется определенной силой и способностью участвовать в различных химических реакциях.
Ионные связи образуются между атомами, у которых есть разность зарядов, например, между металлами и неметаллами. Ковалентные связи возникают, когда атомы вещества обменивают пары электронов, что позволяет им образовывать молекулы и кристаллические структуры. В металлических связях электроны существенно подвижны и могут свободно перемещаться в кристаллической решетке металла.
Благодаря этому разнообразию химических связей у атомов, возможности реакций между веществами практически неограничены. Атомы могут соединяться, образуя различные химические соединения с разными свойствами. Это позволяет создавать бесчисленное количество материалов различного назначения – от биологически активных веществ до полимеров, сплавов и керамики.
Таким образом, сложность химических связей и их разнообразие являются главной причиной того, что число простых веществ превышает число химических элементов. Это открывает перед наукой огромные возможности для изучения и применения химических реакций в разных областях науки и технологии.
Особенности классификации веществ
Важной особенностью классификации веществ является разделение на элементы и соединения. Элементы – это вещества, состоящие только из одного вида атомов, например, кислород или железо. Соединения – это результат соединения различных элементов в определенных пропорциях, например, вода (H2O) или углекислый газ (CO2). Это разделение позволяет упростить классификацию и описание веществ, а также понять их основные химические свойства и реактивность.
Другой важный аспект классификации веществ – разделение на органические и неорганические соединения. Органические соединения обладают характеристиками, связанными с углеродом, и часто являются основой для живой материи. Неорганические соединения – это все остальные виды соединений, которые включают множество разнообразных веществ, таких как соли, кислоты, основания и многое другое. Это разделение помогает облегчить классификацию и систематизацию веществ и стать основой для изучения и понимания основных принципов реакций и свойств веществ.
Кроме того, для классификации веществ используются такие параметры, как состояние (твердое, жидкое, газообразное), структура, функциональные группы и множество других химических свойств. Все эти особенности позволяют разделить и систематизировать широкий спектр веществ и предоставляют базу для дальнейшего изучения и понимания химической природы веществ.
- Введение в классификацию веществ.
- Различение на элементы и соединения.
- Классификация на органические и неорганические соединения.
- Использование параметров, таких как состояние, структура, функциональные группы и др.
Вопрос-ответ:
Почему число простых веществ превышает число химических элементов?
Главная причина заключается в том, что простые вещества могут образовывать разнообразные соединения, имеющие различные свойства и состав. Это позволяет им обладать большим разнообразием и участвовать в широком спектре химических реакций. В то же время, число химических элементов ограничено и составляет всего около 118 элементов, которые лишь комбинируются между собой. Таким образом, простые вещества имеют больше возможностей взаимодействовать друг с другом и образовывать новые соединения.
Почему простые вещества могут образовывать разнообразные соединения?
Простые вещества, такие как кислород, водород, азот и другие, имеют уникальные химические свойства и структуру, благодаря которым они могут образовывать множество различных соединений. Например, кислород может вступать во взаимодействие с различными элементами и образовывать оксиды, как кислотные, так и основные. Способность простых веществ образовывать разнообразные соединения обусловлена их способностью образовывать химические связи с другими элементами.
Каково число химических элементов и простых веществ?
На данный момент в таблице химических элементов известно 118 элементов. Это число является ограниченным, так как элементы ограничены определенным количеством электронных оболочек и возможных комбинаций друг с другом. В то же время, число простых веществ значительно превышает число химических элементов. Это связано с тем, что каждый химический элемент может образовывать несколько различных простых веществ, а также существует большое количество элементов, которые пока не вошли в таблицу химических элементов.
Какие свойства и состав имеют простые вещества?
Простые вещества состоят из одного типа атомов или молекул и не могут быть разложены на более простые вещества химическими методами. У каждого простого вещества есть своя уникальная структура и химические свойства. Например, водородная молекула H2 состоит из двух атомов водорода и обладает свойством быть легковоспламеняющейся. Кислородный газ O2 состоит из двух атомов кислорода и необходим для поддержания жизни на Земле. Таким образом, простые вещества имеют различные свойства и состав, что позволяет им обладать большим разнообразием и играть важную роль в химии и природе в целом.